식품의약품안전처는 한국화이자제약 ‘코미나티주0.1mg/mL(5-11세용)’ 29만9천회분에 대해 3월29일 국가출하승인을 했다.
국가출하승인이란 백신이 시중에 유통되기 전에 제조단위(로트)별로 국가가 검정시험 결과와 제조사의 제조·시험 결과를 종합적으로 평가해 품질을 한 번 더 확인하는 제도이다.
식약처는 코미나티주0.1mg/mL(5-11세용) 29만9천회분에 대해 검정시험을 수행하고 제조사의 제조‧시험 자료를 검토한 결과 효과성(역가, 확인, 함량 등), 안전성(무균, 엔도톡신 등), 품질(성상, pH, 실용량 등)을 확인했으며, 기준에 적합해 국가출하승인을 결정했다고 밝혔다.
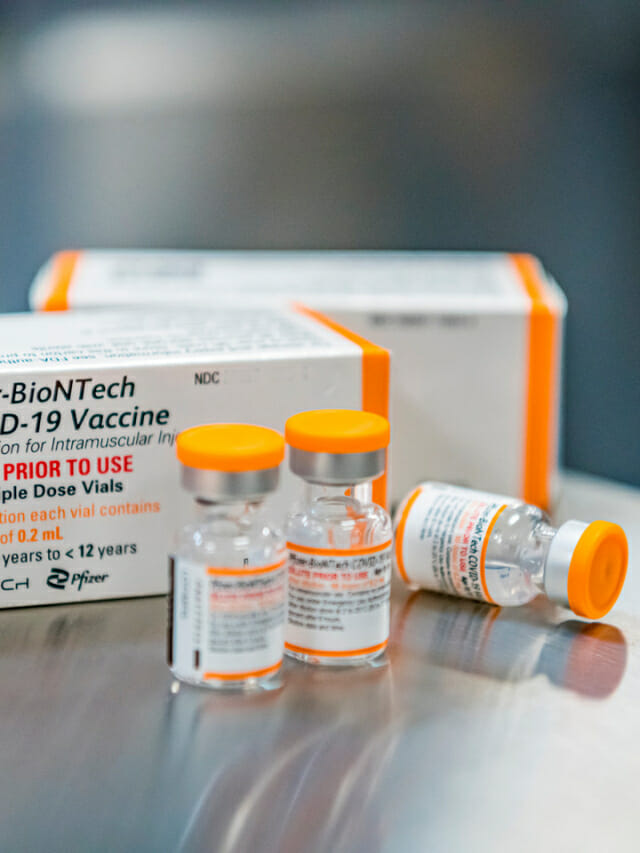
코미나티주0.1mg/mL(5-11세용)는 5~11세의 코로나19 예방 목적으로 미국 화이자사가 개발·생산한 mRNA 방식의 백신으로 앞서 허가된 ‘코미나티주’, ‘코미나티주0.1mg/mL’과 유효성분(토지나메란)은 같으나, 1회 접종 시 투여량은 1/3(10㎍)로 줄었다.
식약처는 이번 국가출하승인이 어린이 확진자가 늘고 가족 간 감염이 증가하는 상황에서 어린이의 코로나19 예방과 중증으로 악화 방지에 도움을 줄 것으로 기대한다고 밝혔다.
한편 보건당국은 오는 31일부터 5세에서 11세 소아에 대한 백신 접종을 시작한다고 밝혔다.
관련기사
- 화이자 CEO "일반인도 코로나19 4차 접종 필요"2022.03.15
- 정은경 "5~11세 소아 접종계획 내주 발표…고위험군 필요"2022.03.07
- 화이자, FDA에 5세 미만 어린이에게도 백신 긴급사용 승인 요청2022.02.03
- 美 FDA, 화이자 코로나19 알약 치료제 첫 승인2021.12.23
접종 대상은 생일이 지나지 않은 2010년생부터 생일이 지난 2017년생까지로 약 307만 명이다.
코로나19 확진 이력이 있는 경우 소아 당뇨, 만성폐질환 등 중증 위험이 높은 고위험군 소아는 2차례 기초 접종이 권장되지만, 일반 소아는 접종이 권고되지 않는다.












