식품의약품안전처(식약처)가 한국노바티스의 ‘졸겐스마주(오나셈노진아베파르보벡)’에 대해 국내 허가를 결정했다.
졸겐스마주는 ‘생존운동뉴런1’ 유전자가 돌연변이 등으로 기능을 하지 못해 발생하는 퇴행성 신경질환 척수성 근위축증 환자에게 정맥으로 단회 투여하는 치료제다. 척수성 근위축증은 전 세계적으로 신생아 1만 명당 1명꼴로 발생하는 희귀질환이다.
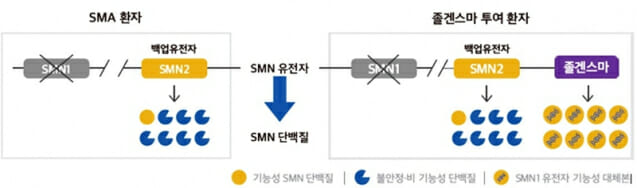
약은 생존운동뉴런1(SMN1) 유전자에 이중대립형질 돌연변이가 있는 척수성 근위축증 환자 가운데 ▲제1형 척수성 근위축증 임상적 진단 ▲생존운동뉴런2(SMN2) 유전자의 복제수가 3개 이하인 경우에 사용되도록 허가가 이뤄졌다.
약은 첨단재생바이오법 제30조에 따른 ‘장기추적조사’ 대상 의약품으로 분류돼 식약처로부터 허가를 받았다. 첨단바이오의약품은 살아있는 세포·조직이나 유전물질 등을 원료로 한 세포치료제·유전자치료제를 말한다. 첨단재생바이오법에 따라 장기추적조사 등 안전관리 및 연구개발·제품화 지원 등을 받을 수 있다.
관련기사
- 휴먼스케이프, ‘희귀질환 극복의 날’ 맞아 랜선 캠페인2021.05.21
- 희귀 백혈병·유방암 의약품 3종 희귀의약품 지정2021.05.03
- 바이오 빅데이터 구축 시동…희귀질환 1만명 모집2020.06.29
- "韓 고정밀 지도, 구글·애플에 내주면 10년간 최대 197조원 피해"2026.02.03
노바티스는 투여일로부터 15년간 이상사례 등을 추적해 처음 판매한 날부터 1년마다 장기추적조사 한 내용과 결과 등을 식약처에 보고해야 한다.
식약처는 “이번 품목 허가가 척수성 근위축증 환자들에게 새로운 치료 기회를 제공할 수 있을 것으로 기대한다”고 밝혔다.












