기초과학연구원(IBS, 원장 노도영)은 미토콘드리아 DNA의 아데닌(A) 염기를 교정하는 'TALED(Transcription Activator-Like Effector-linked Deaminase)' 기술을 개발했다고 26일 밝혔다.
미토콘드리아 유전질환 치료와 치료제 개발에 활용이 기대된다. 관련 연구 성과는 학술지 '셀(Cell)'에 실렸다.

미토콘드리아는 에너지를 만들어내는 세포 내 소기관이다. 미토콘드리아 DNA에 변이가 일어나면 어린이 발달지연 등을 일으키는 희귀 유전질환이나 암·당뇨병·노화 관련 질환을 일으킬 수 있다.
병원성 미토콘드리아 DNA의 돌연변이 95개 중 90개는 DNA 염기 하나가 변이된 '점 돌연변이'다. 점 돌연변이를 원래의 염기로 교정해 병원성 미토콘드리아 유전질환을 치료하는 연구가 진행돼 왔다. 2020년 미토콘드리아 DNA의 시토신(C) 염기를 티민(T)으로 교정하는 기술이 개발됐지만, 점 돌연변이의 10%에 해당하는 9개만 고칠 수 있다는 한계가 있었다.
IBS 유전체교정연구단 연구진은 미토콘드리아에서 아데닌(A) 염기를 다른 염기로 교정하는 기술을 최초로 개발했다. 이는 점 돌연변이 39개(43%)를 고칠 수 있어, 미토콘드리아 DNA의 표적 범위를 비약적으로 늘렸다. 미토콘드리아 관련 다양한 종류의 동물 질환 모델 제작 및 미토콘드리아 유전질환의 근본적인 치료 길을 열었다고 연구진은 설명했다.
연구진은 세균에서 유래한 'DddA 시토신 탈아미노 효소'에 주목했다. 기존의 탈아미노 효소는 DNA 단일 가닥에 작동하는 반면, DddA는 이중가닥에 작동한다. 연구진은 DddA가 DNA 이중가닥을 일시적으로 풀어 탈아미노효소를 DNA 이중 가닥에 접근할 수 있게 하리라는 가설을 세웠다. 이를 바탕으로 DddA와 아데닌 탈아미노 효소(TadA 8e)를 융합한 염기 교정 기술인 TALED를 제작했다.
TALED를 인간 미토콘드리아 DNA에 적용한 결과, 아데닌이 탈아민화되며 구아닌으로 치환됐다. 인간 미토콘드리아 DNA의 아데닌 염기 교정에 최초로 성공한 것이다.
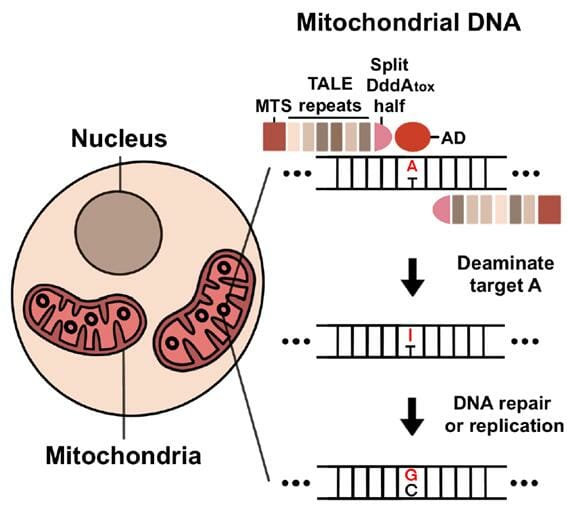
나아가 시토신 탈아민화 효율을 높이는 UGI(Uracil-DNA glycosylase inhibitor) 단백질을 TALED에 융합하면 시토신과 아데닌의 염기 교정을 동시에 일으킬 수 있음을 확인했다. UGI가 없으면 시토신 염기교정은 일어나지 않고 아데닌 염기만 교정되었다.
시토신과 아데닌의 동시 교정은 원하는 유전자의 무작위 돌연변이 유발에, 아데닌 염기의 선택적 교정은 질병 치료 또는 질병 모델 제작에 사용될 수 있다. 미토콘드리아 DNA를 교정하는 유용한 도구 2가지를 개발한 것이다.
관련기사
- 인간 유전체 정보, 남은 퍼즐 조각 모두 찾았다2022.04.01
- 유전자 가위로 부작용 없는 암 치료법 개발2022.02.23
- 개복 없이 초음파 쐬어 암세포 괴사시키는 기술 개발2022.02.17
- 소비자원, 1인당 10만원씩 보상...SKT "신중히 결정"2025.12.21
연구진은 총 17개의 미토콘드리아 DNA 내 표적 염기서열에 대해 TALED를 만들어 검증, 최대 49%에 달하는 높은 아데닌 교정 효율을 보여주었다.
교신저자인 김진수 전 유전체교정연구단장은 "마땅한 치료법이 없었던 미토콘드리아 유전질환의 근본적 해결책을 제시했다"라며 "TALED는 다른 세포소기관인 엽록체에서도 작동 가능해 식물에도 적용할 수 있는 만큼, 분자생물학과 유전학 뿐 아니라 바이오제약·생명공학·농림수산업·환경 산업에도 폭넓게 기여할 것"이라고 말했다.