암은 일반 세포에 비해 산소가 부족한 환경에서도 잘 살아남는다. 암세포의 저산소 환경 적응을 막는 것이 새로운 항암 기술로 떠오르고 있다.
한국생명공학연구원(원장 김장성)은 저산소 환경에서 세포가 안정성을 유지하는 메커니즘을 규명했다고 27일 밝혔다. 암세포를 제어할 수 있는 새로운 대안을 찾은 것으로, 향후 항암 신약 개발에 활용이 기대된다.

산소는 세포 생존과 성장의 핵심 요소 중 하나다. 대기 중 산소 농도인 약 21%보다 낮은 저산소 환경에 노출된 세포는 살아남기 위해 분자 수준에서 리프로그래밍을 진행하며, 적응에 실패한 세포는 사멸된다. 암세포는 조직 내에서 저산소 환경에 빈번히 노출되는 탓에 저산소 적응 리프로그래밍이 더 활발히 일어나 정상 세포보다 생존 확률이 높다.
세포는 세포 내 유전체가 물리적·화학적으로 안정성에 훼손을 입으면 사멸한다. 유전체 안전성에 관여하는 요소 중 하나가 세포의 핵 내부에서 DNA를 감싸는 히스톤 단백질의 메틸화이다. 단백질 메틸화란 히스톤 단백질에 특정 효소로 인해 변형이 일어나는 것을 말한다.
생명연 김정훈·김정애 박사 연구팀은 저산소 환경에서 히스톤 메틸화 효소인 SETDB1 단백질이 유전체의 안정성을 유지하게 하며, 이를 제어하면 유전체의 안정성이 깨져 세포사멸이 유도됨을 밝혔다.
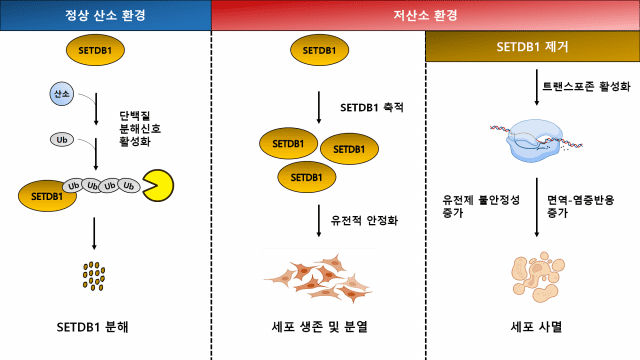
연구팀은 SETDB1 단백질이 종양 억제 유전자인 본히펠린다우(VHL)와 결합해 세포 안에서 분해되는 현상을 발견했다. 이를 통해 산소 농도가 낮아지면 SETDB1 단백질과 VHL의 결합이 약해지며 SETDB1 단백질이 증가한다.
SETDB1 단백질의 증가를 억제하면 SETDB1 단백질에 의한 히스톤 메틸화가 정상적으로 이뤄지지 않아 비정상적 유전자 발현이나 DNA 손상이 발생해 유전체가 불안정해지고 세포 사멸이 일어남을 확인했다.
관련기사
- [1분건강] 암 생존자, 신체활동 많을수록 심혈관질환 위험 감소2023.11.09
- 3D 바이오프린팅 기술로 암세포 잡는다2023.07.11
- 코스피 9% 반등…개인돈 1조8천억원 몰렸다2026.03.05
- LG전자, 토요타에 미국 표준특허 16건 양도2026.03.05
연구진은 “암과 같은 저산소 적응성 질환을 효과적으로 제어할 수 있는 분자 표적을 찾은 것"이라며 "향후 SETDB1을 억제하는 혁신 신약 개발에도 활용될 수 있을 것"이라고 기대했다.
이번 연구는 과기정통부 융합연구사업과 개인기초연구사업, 생명연 주요사업의 지원으로 수행됐으며, 학술지 '핵산 연구(Nucleic Acids Research)에 최근 게재됐다. 논문 제목은 Hypoxia stabilizes SETDB1 to maintain genome stability 이다.












