“이제 시작입니다.”
지난 15일 충북 오송 식품의약품안전처. 오유경 식약처장이 국내 첫 품목허가를 결정한 불면증 인지행동 치료 앱 ‘솜즈(Somzz)’를 두고 이렇게 말했다. 전 세계 14번째, 불면증 분야는 미국·독일·영국에 이은 4번째 허가였다.
‘솜즈’로 혜택을 볼 환자의 규모에 대해 오 처장은 현재 국내 불면증 환자의 수가 67만 명인 점, 앞으로 늘어날 불면증 환자 수까지 고려해 “조금 더 많아지지 않겠느냐”고 했다.
식약처는 허가 시기를 특정하진 않았지만 불면증 증상 개선을 목적으로 임상시험 단계에 있는 2호 제품이 있다고 밝혔다. 파이프라인에 있는 디지털치료기기들도 30개 이상 존재한다고도 했다.
현재 도대체 무슨 일이 벌어지고 있는 걸까?
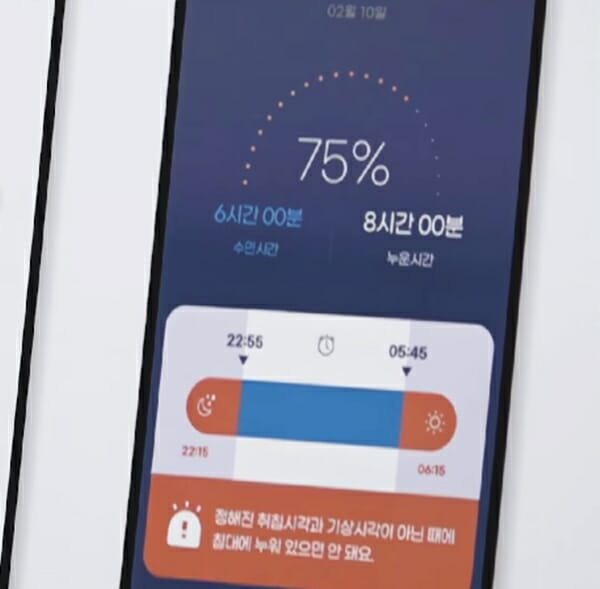
첫 DTx 허가 “문이 열렸다”
당신이 불면증을 겪고 있다고 가정해보자. 정신건강의학과에 내원한 당신에게 의사는 불면증 진단을 내렸다. 초기 치료법으로 의사가 제사한 것은 불면증 인지행동치료법이다. 이것은 약물이 없는 치료방법이다. 진료가 끝나자 원내에서 당신은 의사가 안내한 솜즈앱을 다운로드받게 된다. 이후 6주~9주 동안 당신은 솜즈앱을 사용해 불면증을 개선시키게 된다. 효과가 없다면 그때는 약물 치료로 전환되게 된다.
이번에 식약처가 허가를 한 ‘솜즈’는 바로 이런 역할을 맡는 모바일 앱으로, ‘디지털치료기기(Digital Therapeutics, DTx)’이다.
품목허가가 결정됐지만 당장 솜즈를 사용할 수 있는 것은 아니다. 식약처의 혁신의료기기로 지정된 솜즈에 대해 보건복지부는 다음달말 사용 실시기관을 고시할 예정이다. 이후 개발사인 에임메드가 한국보건의료연구원에 동 요건에 적합한 실시기관의 정보를 사용 신고하고, 결과를 통보받은 후에 본격적인 사용이 이뤄지게 된다.
전문가들은 이번 허가에 상당한 의미가 있다고 본다. 김법민 범부처전주기의료기기연구개발사업단 단장(고려대 바이오의공학부 교수)은 “물꼬가 트였다”고 말했다.
국내 1호 허가 제품이란 상징성은 큽니다. 그만큼 향후 이 제품이 얼마나 활용하기 편리하고, 효용성이 좋으냐에 초점이 맞춰질 겁니다. 과연 DTx가 얼마나 수익을 올리는 제품군이 될 것인지에 개발자뿐만 아니라 해외기업들도 관심을 갖고 지켜보겠죠. 결국 시장이 선택하게 될 겁니다.
강성지 한국제약바이오협회 디지털헬스위원회 간사(웰트 대표)는 “이번 허가는 우리나라 DTx를 본격적으로 시작한다는 신호탄”이라고 분석했다. 그러면서 ‘최적의 환경 조성’이 필요하다고 강조했다.
“DTx는 계속 진화하는 제품입니다. 사용률, 치료성공률, 수가 차등 지급 등에 대한 고민이 정부와 업계에서 이뤄진다면 우리나라가 우위를 점할 수 있을 겁니다. DTx가 가져올 미래는 결국 의료의 진화일 테니까요.”
관련해 미국 시장조사기관 얼라이드 마켓 리서치는 글로벌 디지털 치료기기 시장이 지난 2020년 35억3천729만 달러에서 2030년까지 235억6천938만 달러에 이를 것으로 전망했다. 2030년까지 연평균 성장률만 20.6%에 달한다는 것.
특히 북미지역을 중심으로 DTx는 빠른 성장이 진행 중이다. 이는 보험급여와 일선 의료 현장에의 빠른 도입에 힘입은 결과다. 미국의 DTx 시장 수익은 2020년 9천887만 달러에서 2025년 8억1,780만 달러로 52.6%의 연평균 성장률로 팽창될 것으로 예측된다.
글로벌 시장의 DTx 제품들은 신약 개발로 해결되지 못했거나 인지행동 치료 등을 통한 치료효과가 큰 분야를 중심으로 개발이 이뤄지고 있다. 미국 식품의약국(FDA)의 승인을 받은 제품들은 ▲조현병 ▲2형당뇨 ▲오피오이드중독 ▲PTSD ▲공황장애 ▲약물중독 등의 분야에 치료효과가 있다.
그렇다고 해서 미국에서 나온 DTx 제품들이 시장을 지배하고 있다고 말하긴 어렵다. 비교적 일찍 시판됐다고 해서 해외 제품들이 우리나라 시장을 적극 공략하리란 전망도 낮다. 이유는 강한 규제와 급여 체계를 충족할만한 제품의 수가 부족하고, 그들의 제품 서비스도 아직은 완성되지 않았다는 게 전문가의 분석이다.
강승지 간사는 DTx 제품들의 디지털 진화에는 우리나라가 최적의 환경을 갖추고 있다고 본다. 글로벌 DTx 시장을 선도할 수 있는 여러 조건이 충족돼 있다는 것이다.
우리 시장의 크기나 수가체계 한계를 고려하면, 해외 기업들에게는 그리 매력적이진 않죠. 우리나라는 방어적 태도가 아닌 공격적 전략을 짤 필요가 있습니다. 국내 ICT 장점을 살려서 글로벌에 진출해 현지 제품들과 겨룰 경쟁력 확보가 핵심입니다. 이것이 가능한 이유는 현재까지 시판 및 개발된 국내·외 DTx 제품들이 치료기기로써 인정은 받았지만 디지털 측면에서는 미흡하기 때문입니다. 그 누구도 아직은 괄목할 만한 성과를 내고 있지 않아요.

DTx는 전자약? 디지털치료제? 디지털치료기기? 약? 의료기기?
식약처의 ‘디지털치료기기 허가·심사 가이드라인(2020. 8)’에 따라 디지털치료기기는 의학적 장애나 질병을 예방· 관리· 치료하기 위해 환자에게 근거 기반의 치료적 개입을 제공하는 ‘소프트웨어 의료기기(SaMD)’를 말한다. 디지털치료기기의 사용은 치료적 개입이 필요한 ‘환자’를 대상으로 한다.
그렇다면 ‘소프트웨어 의료기기(SaMD)’란 무엇인가. 식약처는 하드웨어에 종속되지 않고 의료기기의 사용목적에 부합하는 기능을 가지며 독립적인 형태의 소프트웨어만으로 이뤄진 의료기기로 정의하고 있다.
관련기사
- 디지털치료제 활성화 방안 모색 전문가 한 자리에2023.01.11
- 셀트리온 ‘램시마’, 10년 만에 100개국서 허가받았다2023.01.03
- 디지털 치료기기 개발지원 컨설팅 호평…"국내 1호 기기 출시 박차”2022.09.20
- 우울증‧공황장애 개선 디지털치료기기 제품화 물꼬 터2022.04.18
디지털 치료제 및 전자약이라는 용어가 혼용되면서 DTx가 ‘약’인지 ‘의료기기’인지를 헷갈려하는 사람이 많다. 결론부터 설명하면, 우리나라에서 DTx는 ‘의료기기’다. DTx가 목적 상 치료제와 유사하기 때문에 용어가 통용되고는 있지만 기술적으로는 의료기기에 해당한다. 의약품과 달리 의료기기는 의사의 처방이나 판매 방식이 별도로 정해진 것이 없다.
솜즈의 경우에 한해 의료기관에서 진료를 받은 다음에 앱을 환자의 스마트폰에 다운받아서 사용하는 형식으로 진행된다. 이에대해 식약처 관계자는 이렇게 설명했다.
솜즈는 초기 의학적 개입이 필요한 환자를 위한 제품으로, 임상시험도 의학적 개입을 전제로 진행됐습니다. 의학적 개입이 필요하다고 해서 의약품으로 보기는 어렵죠. 의약품 트랙을 따라간 것이 아니라 전 시점을 전부 의료기기 프로세스로 관리하고 있습니다.












