국내 연구진이 성인의 뇌가 기억력을 유지하는 메커니즘을 밝혔다.
KAIST(총장 신성철)는 생명과학과 정원석 교수와 이준혁 박사과정 연구팀이 한국뇌연구원(원장 서판길) 박형주 박사 팀과 공동연구로 이전까지 알려지지 않은 새로운 뇌 항상성 유지 기전을 처음으로 밝혀 국제학술지 네이처(Nature)에 공개했다고 5일 발표했다.
성인 '해마'에서는 학습 및 기억 형성 중 기존 시냅스는 사라지고 새로운 시냅스가 생기는 시냅스 재구성이 일어난다. 하지만 어떻게 시냅스가 사라지고 이러한 시냅스 제거가 학습과 기억 과정 중 어떤 역할을 하는지는 알려지지 않았다.
해마(hippocampus)는 뇌 부위 중 하나로 학습과 기억, 새로운 것 인식 등의 역할을 한다. 시냅스(synapse)는 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런은 뇌와 척수에 집중돼 있다.
공동연구팀은 중추 신경계에서 다양한 역할을 수행하는 신경교세포 중 가장 숫자가 많은 '별아교세포'가 뇌 발달 시기에 시냅스를 먹어 없앤다는 정원석 교수의 선행 연구 결과(네이처(Nature), 2013년)에 착안, 연구를 진행했다. 그 결과, 성체 뇌에서도 별아교세포가 불필요한 시냅스를 끊임없이 제거하고 있음을 발견했고, 이 현상이 학습 및 기억에 중요한 해마 내 흥분성 시냅스 회로 유지를 가능하게 한다는 사실을 증명했다.
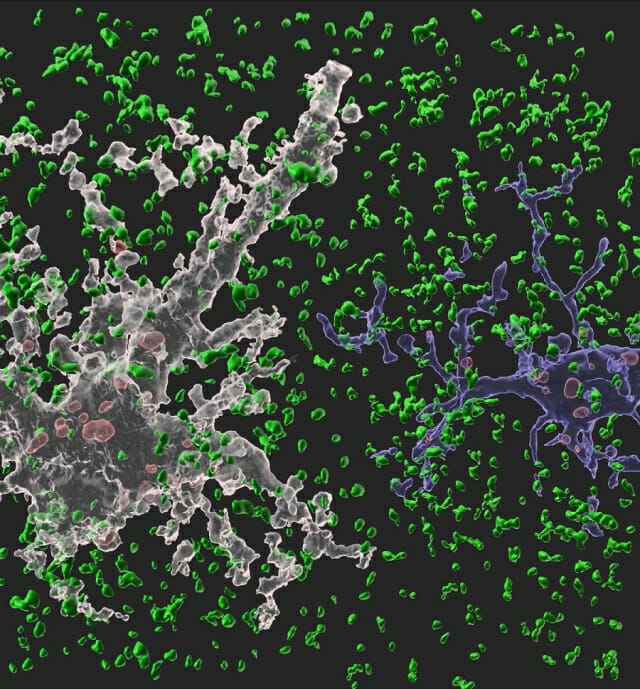

이전에는 신경교세포의 시냅스 제거 현상을 전자 현미경 또는 시냅스 염색법을 사용해 확인했다. 그러나 이 방법은 신경교세포에 의해 먹힌 시냅스가 세포 내 산성 소화기관에서 급속히 분해되기 때문에 잔여 시냅스를 표시하고 관찰하는 데 한계가 있다. 이에 연구팀은 시냅스에 산성화 감지가 가능한 형광단백질 조합(mCherry 물질과 eGFP 물질)을 발현하는 바이러스 기반 시냅스 포식 리포터를 개발했다.
이 형광단백질들은 일반적인 중성 pH 조건에서 원래의 형광 강도를 유지하지만, 세포 속 소화기관 같은 산성 환경에서는 eGFP 물질이 빠르게 분해되어 신호가 사라지고 mCherry 물질은 천천히 분해, 신호를 유지한다는 특징이 있다. 이런 원리를 활용해 연구팀은 mCherry-eGFP를 바이러스를 통해 흥분성 및 억제성 시냅스에 각각 발현시켰고 이후 mCherry-eGFP로 표시된 시냅스와 달리 신경교세포에 의해 먹힌 시냅스는 mCherry 물질만의 단독 신호로 관찰됨을 확인했다.
연구팀은 새로 개발한 방법을 이용해 기존 방법으로는 관찰할 수 없던 현상인 별아교세포가 성인 해마에서 시냅스를 지속적으로 제거하며 특히 흥분성 시냅스를 더 많이 제거하고 있음을 발견했다. 연구팀은 뇌의 면역세포라 불리는 미세아교세포보다 별아교세포가 주도적으로 정상 해마의 흥분성 시냅스를 제거하고 있음을 확인, 미세아교세포가 시냅스를 제거하는 주된 세포일 것이라는 기존 학설을 뒤집었다고 KAIST는 설명했다.
미세아교세포를 인위적으로 제거했을 때는 시냅스의 수가 변하지 않았지만, 해마의 별아교세포가 시냅스를 먹지 못하도록 유전자 조작을 했을 때는 비정상적인 시냅스가 과도하게 급증하고 정상적인 해마 신경 회로 기능과 기억 형성 능력이 떨어진다는 것을 처음으로 관찰했다.
또 연구진은 유전자 변형을 통해 별아교세포의 시냅스 제거 작용을 억제한 생쥐에서는 해마 내 시냅스 연결 가소성과 기억 형성에 문제가 생김도 발견했다. 이는 불필요한 시냅스들을 별아교세포가 제거하지 않는다면 뇌의 정상적인 학습과 기억 능력이 유지될 수 없다는 것을 의미한다.
연구팀은 이번 연구성과를 통해 별아교세포에 의한 성인 뇌의 흥분성 시냅스 재구성이 정상적 신경 회로망 유지 및 기억 형성에 필수적인 기전이라고 제시했다. 이 메커니즘은 향후 뇌 기능 및 관련 신경 회로의 항상성 유지에 관한 다양한 연구에 활용할 수 있을 것으로 기대됐다.
연구팀은 "비정상 수준의 시냅스 수 변화는 자폐 스펙트럼 장애, 조현병, 치매 및 여러 형태의 발작과 같은 다양한 신경질환의 유병률과 연관성이 높다"며 "시냅스 수를 다시 정상으로 회복하기 위해 별아교세포가 시냅스를 먹는 현상을 조절하는 것이 이들 뇌 질환을 치료하는 새로운 전략이 될 수 있다"고 말했다.