유전자 치료는 특정 유전자만을 찾아 잘라내는 일이 핵심이다. 그러나 이 과정에서 목표외에 다른 유전자까지 잘라 자주 유전체 손상과 부작용을 초래한다. 국내 연구진이 이같은 오류를 효과적으로 줄일 방법을 제시했다.
고려대학교는 지성욱 생명과학부 교수 연구팀이 유전자 편집 기술의 원천이 된 미생물에서 크리스퍼(CRISPR) RNA의 새로운 화학적 변형을 세계 최초로 발견하고, 이를 통해 유전자 가위 한계로 꼽혀 온 비표적 문제를 해결하는 데 성공했다고 6일 밝혔다.
연구 결과는 화학 생물학 분야 국제 학술지인 '네이처 케미칼 바이올로지'(IF=13.7)에 온라인으로 지난 5일 게재됐다.
크리스퍼 유전자 가위(CRISPR-Cas9)는 외부에서 침입한 바이러스를 제거하는 미생물 면역 체계로부터 개발된 유전자 편집 기술이다. 편집할 DNA 위치를 안내하는 크리스퍼 RNA가 목표 DNA 서열을 인식하면, 효소인 카스9(Cas9) 단백질이 해당 위치를 절단해 유전자를 교정할 수 있다.
그러나 이를 치료에 적용할 경우, 목표 유전자뿐 아니라 서열이 유사한 다른 유전자까지 함께 절단하는 ‘비표적 문제’가 꾸준히 제기돼 왔다. 이는 유전체 손상과 부작용으로 이어질 수 있어, 크리스퍼 기술의 임상 적용을 가로막아 왔다.
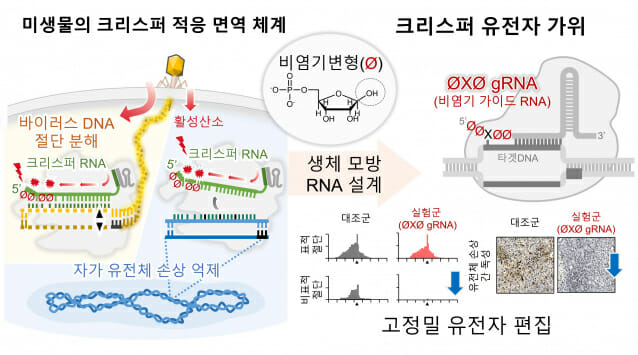
연구팀은 이러한 문제 해법을 미생물 면역 시스템에서 찾았다. 미생물은 유전자 가위를 사용해 외부 바이러스 DNA만 정밀하게 제거하면서도, 자신의 유전체는 손상시키지 않는다. 이에 연구팀은 크리스퍼 유전자 가위가 최초로 발견된 연쇄상구균을 분석, 바이러스 감염 시 크리스퍼 RNA 일부 염기가 사라진 ‘비염기 상태’로 변형된다는 사실을 세계 최초로 규명했다.
비염기 상태는 유전자 서열을 이루는 염기가 제거돼, 구조는 유지되지만 정보는 비어 있는 상태다.
연구팀은 이 변형이 바이러스 감염 과정에서 발생하는 활성산소에 의해 일어나며, 과도하게 활성화된 유전자 가위로부터 미생물 자신의 유전체를 보호하는 자연적인 조절 장치로 작용한다는 점도 함께 밝혀냈다.
연구팀은 이러한 생물학적 현상을 모사해, 비염기 구조를 포함한 새로운 가이드 'RNA(ØXØ)'를 개발했다. 이 기술은 기존에 인위적으로 변형한 유전자 가위보다 비표적 현상을 효과적으로 줄이면서도, 높은 유전자 교정 효율을 나타냈다.

특히, 생쥐 실험에서 기존 크리스퍼 유전자 가위 사용 시 나타났던 간독성이 관찰되지 않았으며, 간암 생쥐 모델에서는 종양 성장을 현저히 억제하는 치료 효과를 보였다. 이는 향후 직접 생체 내에서 적용 가능한 안전한 유전자 치료 기술로 발전할 가능성을 보여준다.
관련기사
- KBSI-고려대, AI·우주과학 대학원 신입생 2027년부터 선발2026.01.28
- 고려대, 올해 노벨화학상 수상자 2인 석좌 교수로 영입…"인류난제 해결"2025.12.11
- 800만명에 1명꼴 급속노화(조로증) 치료법 찾았다2025.07.28
- '대상'이 찜한 생명연 유전자 편집 신기술..."DNA 6개 한번에 처리"2025.04.24
지성욱 교수는 “이번 연구는 자연에서 이미 검증된 생화학적 조절 원리를 유전자 편집 기술에 적용한 사례”라며 “비염기 가이드 RNA는 간단한 화학적 변형만으로 구현할 수 있어, 크리스퍼 유전자 가위의 안전성을 크게 높일 수 있을 것”이라고 말했다.
연구는 한국연구재단 국가연구소사업(NRL2.0), 선도연구센터사업, 리더연구자지원사업과 한국과학기술원 프로그램 지원으로 수행됐다.