국내 연구진이 분자 구조를 마음대로 바꿀 수 있는 기술을 개발했다. AI기반 맞춤형 신약 설계의 전환점이 될 것인지에 관심이 쏠렸다.
KAIST는 이노코어 AI-CRED 혁신신약 연구단(단장 이희승 석좌교수)이 단백질 분자 구조인 펩타이드의 ‘티오아마이드(thioamide) 변환’을 통해 분자의 접힘 방식을 정밀하게 조절할 수 있는 새로운 원리를 규명했다고 16일 밝혔다.
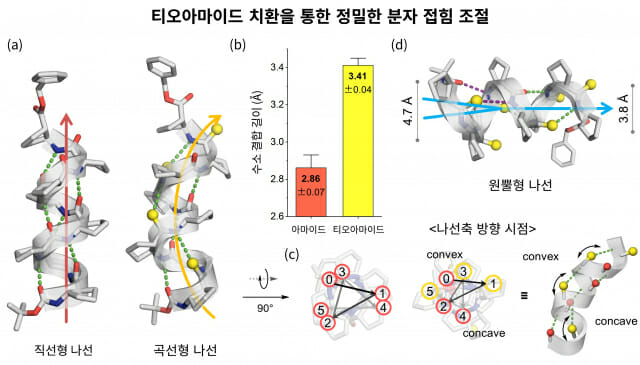
티오아마이드 변환은 탄소와 산소, 질소가 결합한 펩타이드 단백질에서 산소를 황으로 바꾸는 과정을 말한다.

단백질이나 펩타이드 같은 생체분자는 스스로 접히며(폴딩) 입체적인 구조를 만들어야 기능을 수행한다. 이러한 ‘분자의 접힘'은 생명 현상을 결정짓는 핵심 원리이다. 특히, 맞춤형 신약 설계의 출발도 여기로부터 비롯된다.
연구팀은 펩타이드 결합 내 산소 원자(O)를 황 원자(S)로 치환하는 티오아마이드 변환 기술을 통해, 분자가 스스로 접히는 방식을 원자 수준에서 정밀하게 제어할 수 있음을 세계 최초로 입증했다.
이 미세한 변환은 수소결합의 길이와 방향을 바꾸어 기존에 없던 곡선형 및 원뿔형 나선 구조와 대칭성이 높은 매크로사이클을 만들어냈다. 이를 통해 펩타이드가 용매에 더 잘 녹고, 분자 구조를 자유롭게 바꾸거나 되돌릴 수 있으며, 더 크고 복잡한 구조까지 합성할 수 있음을 확인했다.
이희승 석좌교수는 "복잡한 분자 접힘을 ‘원자 한 개 수준의 설계’로 정밀하게 조절한 최초의 사례"라며 "약물의 성능을 높이고, 설계의 자유도 또한 확장할 수 있는 가능성을 제시한 셈"이라고 말했다.
연구팀은 펩타이드가 용매에 더 잘 녹고, 분자 구조를 자유롭게 바꾸거나 되돌릴 수 있으며, 더 크고 복잡한 구조까지 합성할 수 있음을 확인했다.
티오아마이드 변환 기술을 적용한 결과, 황을 포함한 펩타이드의 용해도가 크게 향상돼 분자량이 약 4천 Da(달톤, 분자량의 단위) 정도의, 세계에서 가장 긴 32개 아미노산 β-펩타이드를 용액에서 합성하는 데 성공했다.
은 이온을 이용한 온화한 반응으로 황을 다시 산소로 바꾸는 ‘가역적 분자 편집 기술’도 확립해, 설계 단계에서 분자 구조를 정밀하게 제어할 수 있는 기반을 마련했다.
관련기사
- "AI로 만든 이 기술 있었다면, 3년전 이태원 참사는 없었을 것"2025.09.17
- KAIST, 전북도·전북대·성균관대와 과기정통부 피지컬AI 시범사업 수주2025.08.28
- 이광형 KAIST 총장, AI학과 설립 공론화…"향방 귀추 주목"2025.07.07
- "로봇은 99.999% 신뢰성 필요…휴머노이드 꼭 정답 아냐"2026.02.24
이희승 석좌교수는 “간단한 화학적 변화를 통해 분자의 형태를 정밀하게 제어할 수 있음을 보여준 연구”라며, “AI가 학습하기에 최적화된 구조 데이터를 제공함으로써 향후 AI 기반 혁신 신약 설계의 출발점이 될 것”이라고 밝혔다.
연구 결과는 화학 분야 국제 학술지인 미국화학회지(IF 15.6) 10월 29일 자 온라인판 커버 화면에 게재됐다.












