세계 최초로 재조합 단백질 탄저백신이 국내 기술로 개발됐다.
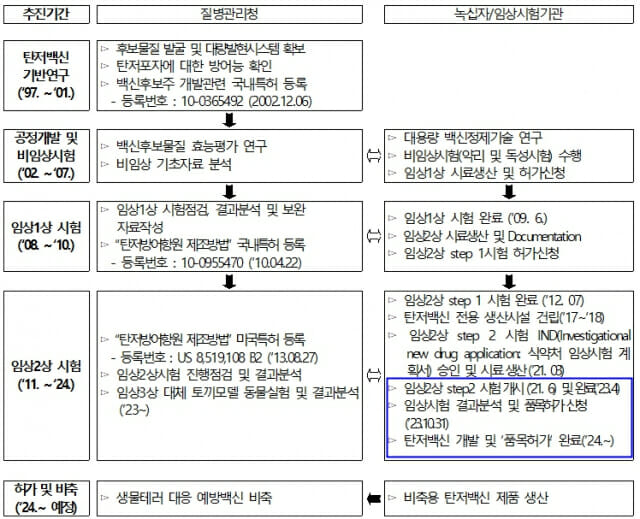
질병관리청은 생물테러 등 국가위기 상황에 대비해 탄저백신의 국내 개발, 생산 자급화를 위해 녹십자와 협력하여 국내 기술로 개발한 세계 최초 ‘재조합 단백질 탄저백신(GC1109)’을 대테러 위기대응 의약품으로 상용화하기 위해 식품의약품안전처에 품목허가를 신청했다고 밝혔다.
질병관리청과 녹십자가 개발한 탄저백신은 탄저균의 방어항원(Protective Antigen, PA) 단백질을 주성분으로 기존 개발된 백신이 갖는 문제점(미량의 잔존 탄저균 독소인자에 의해 부작용 유발의 가능성이 있음)을 개선해 더 안전한 재조합 단백질 탄저백신으로 개발한 세계 최초 사례이다.
건강한 성인을 대상으로 임상 시험한 결과 탄저백신 접종 그룹에서 탄저균 독소를 무력화시킬 수 있는 충분한 항체가 생성됨을 확인하였고, 급성 및 중증의 이상사례는 발생하지 않았으며 경미한 이상증상은 백신 접종 그룹과 위약 접종 그룹 간에 차이가 없음을 확인해 백신의 유효성과 안전성을 확인했다.
탄저균은 사람에게 감염 시 치명률이 높아, 다수의 사람을 대상으로 탄저균 감염에 대한 백신 방어 효과를 확인하는 임상3상 시험 실시가 어려워 ‘공중보건 위기대응 의료제품의 개발 촉진 및 긴급 공급을 위한 특별법’에 따라 백신 효과를 입증할 수 있는 동물규칙(Animal rule)을 적용한 임상3상 대체 동물실험을 수행했다.
이는 동물(토끼)모델을 통한 장기 면역원성 및 탄저균 포자 공격접종에 대한 방어능력을 생존률로 평가하는 시험으로, 동물모델에서 백신 4회차 접종 후 6개월 시점에도 높은 탄저 독소 중화 항체가가 유지되며 탄저균 포자에 대해서도 높은 생존률이 확인되어 뛰어난 효과를 입증했다.
질병관리청은 이번 탄저백신 국내 생산, 개발을 통해 백신주권을 확립하고 해외 백신 수입 비용 절감과 안정적 백신 공급이 가능하며, 국가 공중보건 위기 상황에 대응이 가능할 것으로 예상했다.
지영미 질병관리청장은 “식약처 품목허가 승인이 완료되면 유사시를 대비한 국내 탄저백신 생산 및 비축이 가능할 것으로 기대한다”라며 “생물테러 감염병에 대응할 수 있는 백신을 한국이 생산하고, 보유할 수 있는 것만으로 생물테러 발생을 감소시키는 데 큰 역할을 할 것”으로 전망했다.
한편 탄저란 탄저균에 의해 사람 및 가축에 발생하는 인수공통감염병으로 탄저포자를 흡입하거나(호흡기 탄저), 감염된 동물이나 부산물에 피부가 노출되었을 때(피부 탄저), 오염된 육류를 섭취했을 경우(위장관 탄저) 감염되고 사람 간 전파는 드물다.
상처난 피부를 통해 감염되는 피부 탄저의 경우 항생제 투여로 치료가 가능하나 호흡기 탄저의 경우는 치사율이 매우 높으며 발병 시 조기에 치료하지 않으면 치명률은 97%에 이른다. 탄저포자에 노출된 사람의 발병억제를 위해 시플로프록사신과 같은 항생제를 60일 이상 장기 투여해야 함에 따라 사전예방이 중요한 질병이다.
특히 탄저균은 열악한 환경에서 포자를 형성해 장기간 생존이 가능하고 미사일 등에 탑재해 공기 중 살포가 용이한 특징으로 인해 생물학 무기로 개발되어 테러에 악용될 수 있는 대표적인 생물테러병원체이다.
탄저포자는 2001년 9·11테러 이후 미국 전역에 우편물을 통한 생물테러에 사용되어 22명이 감염되었고 이중 5명이 사망하여 사회적 혼란을 야기한 바 있다.









