미국 식품의약국(FDA)가 지난 17일(현지시간) 유전성 혈액장애인 수혈 의존성 베타 지중해빈혈 환자 치료를 위한 유전자치료제 ‘진테글로’를 승인했다.
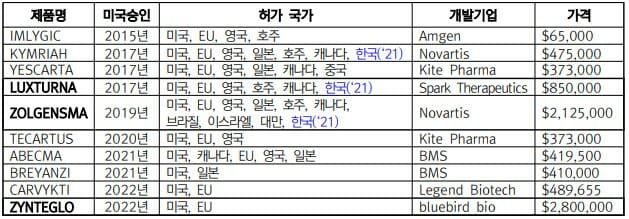
진테글로는 단일 용량으로 투여되는 1회성 유전자치료제로 약값은 약 280만 달러(약 37억 원)다. 현재까지 가장 비싼 치료제인 노바티스의 척수성 근위축증 유전자치료제 졸겐스마의 210만 달러보다 비싸다.
진테글로는 수혈 의존성 베타 지중해빈혈이 있는 성인과 어린이를 대상으로 한 2건의 임상 연구에서 진테글로를 투여받은 41명의 환자 중 89%가 최소 12개월 동안 적혈구 수혈이 필요하지 않는 수혈 독립을 달성한 것으로 알려졌다.
진테글로는 지난 2019년 유럽에서 허가를 받은 후 180만 달러의 가격을 책정했지만, 가격합의에 실패해 유럽시장에서는 철수했다. 제조사인 블루버드는 소아 환자의 조기 활동성 뇌 부신백질이영양증(CALD) 치료를 위한 일회성 요법인 ‘엘리셀(Eli-cel)’의 미국 FDA 승인 심사도 진행 중이다.
전 세계적으로 20개의 유전자치료제가 승인됐다. 이 가운데 미국 FDA는 10개의 유전자치료제를 승인한 상태다. 미국FDA가 허가한 3개의 유전자치료제 및 가격은 ▲럭스터나 85만 달러 ▲졸겐스마 210만 달러 ▲진테글로 280만 달러 등이다. 이는 40만 달러 전후로 형성된 유전자변형 세포치료제 보다 약 2배~7배 비싸다.
한편, 오는 2027년까지 글로벌 유전자치료제 시장의 성장률 44.6%로 전망된다. 현재 400개 이상 기업이 개발을 진행 중이다. 특히 유전자변형 세포치료제 시장은 지난해 기준 21억 달러에서 연평균 39.2% 증가세로 성장 중이다. 오는 2027년 약 153억 달러의 시장을 형성할 것으로 전망된다.












