서울대병원의 소아백혈병환자 대상 ‘CAR-T’ 치료가 첫 고위험 첨단 재생의료 임상연구로 승인됐다.
이번 승인은 ‘첨단재생의료 및 첨단바이오의약품안전 및 지원에 관한 법령(첨단재생바이오법)’ 시행 이후 첫 승인된 임상연구다.
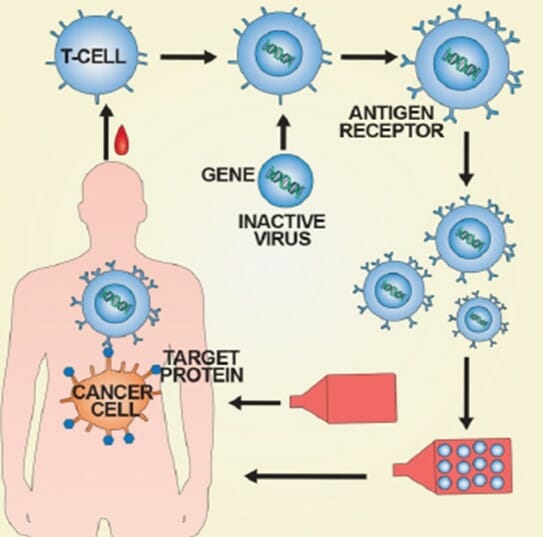
보건복지부와 식품의약품안전처는 서울대병원 측의 연구 승인 건을 ‘사람의 생명 및 건강에 미치는 영향이 불확실하거나 그 위험도가 큰 임상연구’로 분류했다. 고위험 임상연구는 이전의 치료와는 다른 획기적인 방법으로 희귀난치질환자들의 치료 등이 가능하지만 위험도가 높기 때문에 안전성과 유효성에 대해 까다로운 심사가 요구된다.
첨단재생의료 및 첨단바이오의약품 심의위원회와 식약처는 해당 건이 1호 고위험 임상연구인 점을 고려, 제출받은 임상연구계획 등 관련 자료를 토대로 연구 실시 역량과 연구 대상 보호 여부, 안전성·유효성 등을 검증했다고 밝혔다.
이번에 승인된 임상연구는 CAR-T를 사용한 소아청소년 급성 림프모구백혈병 환자의 치료가 목적이다. 급성림프모구백혈병은 백혈구 중 림프구 계열의 세포가 악성으로 증식하는 질환이다. 소아 백혈병의 약 80%를 차지한다.
그동안 소아청소년 급성림프모구백혈병 환자들은 항암화학요법 등의 치료를 받아왔다. 다만, 재발성·불응성 환자의 경우, 기존 치료로는 백혈병 세포가 감소하지 않아 백혈병 치료에 한계가 있었다.
관련기사
- 복지부, 첨단재생의료실시기관 3차 지정 사전설명회 마쳐2021.08.03
- 미·이란 전쟁 쇼크, 국제유가 80달러 넘어섰다2026.03.06
- LG전자, 토요타에 미국 표준특허 16건 양도2026.03.05
- "AI가 5분 만에 소장 쓰는 시대"…법조계 시간당 과금 저문다2026.03.05
CAR-T를 사용한 치료는 암세포만을 표적으로 삼아 체내 정상 세포 손상을 최소화한다는 장점을 갖고 있다. 복지부·식약처는 치료 효과 향상과 함께 부작용도 줄어들 것으로 기대했다.
복지부 김영학 재생의료정책과장은 “앞으로 여러 희귀난치질환에 대한 임상연구를 통해 희귀난치질환자들의 치료 기회를 제고할 것”이라며 “임상연구 결과를 토대로 추후 많은 환자들에게 제공될 수 있는 치료제가 개발되기를 바란다”고 밝혔다.












